消毒与灭菌效果的评价方法与标准 GB15981-1995
目录
[隐藏]第一篇 压力蒸汽灭菌效果评价方法与标准
主题内容与适用范围
本方法规定了压力蒸汽灭菌技术标准及其评价灭菌效果的检测方法 本方法适用于对压力蒸汽灭菌设备灭菌效果的评价。
试剂
本标准所用试剂,凡未说明规格者,均为分析纯(AR),水为蒸馏水。
- 蛋白胨
- 葡萄糖
- 溴甲酚紫酒精溶液:取溴甲酚紫2.0g,溶于100mL95%乙醇中。
- 溴甲酚紫蛋白胨水培养基配制:蛋白胨10.0g,葡萄糖5.0g,溶于1000mL蒸馏水中,调pH值至7.0~7.2,然后再加2%溴甲酚紫酒精溶液0.6mL,摇匀后,按5mL/管,分装包口,置压力蒸汽灭菌器中,于115℃灭菌40min后备用。
指示菌
嗜热脂肪杆菌芽胞(ATCC 7953或SSI K31)菌片,含菌量为5×105~5×106cfu/片,121℃下,杀灭90%微生物所需时间D121值为1.3~1.9min,杀灭时间(KT值)为≤19min,存活时间(ST值)为≥3.9min。
化学指示剂
需用卫生部批准的化学指示剂。
技术要求
检测方法
- 生物学指标(用作压力蒸汽灭菌设备灭菌效果的依据)。
- 将嗜热脂肪杆菌芽胞菌片两个分别放入灭菌小纸袋内,置于标准试验包中心部位。
- 灭菌柜室内,上、中层中央和排气口处各放置一个标准试验包(由3件平纹长袖手术衣,4块小手术巾,2块中手术巾,1块大手术巾,30块10cm×10cm、8层纱布敷料包裹成25cm×30cm×30cm大小)。手提压力蒸汽灭菌器用通气贮物盒(22cm×13cm×6cm)代替标准试验包,盒内盛满中试管,指示菌片放于中心部位两只灭菌试管内(试管口用灭菌牛皮纸包封),将盒平放于手提压力蒸汽灭菌器底部。
- 经一个灭菌周期后,在无菌条件下,取出标准试验包或通气贮物盒中的指示菌片,投入溴甲酚紫葡萄糖蛋白胨水培养基中,56℃培养48h,观察培养基颜色变化。
- 化学指标
- 在物品包外用化学指示胶带,可作为物品是否经过灭菌的处理标志。在物品包内中心部位用化学指示剂,可作为物品是否灭菌的参考标志。
结果判定及评价
- 同次检测中,标准试验包或通气贮物盒内,每个指示菌片接种的溴甲酚紫蛋白胨水培养基全部不变色,判定为灭菌合格。指示菌片之一接种的溴甲酚紫蛋白胨水培养基由紫色变为黄色时,判定为灭菌不合格。
- 化学指示剂的颜色变为与灭菌合格标准色相同时,或熔化时作为灭菌合格的参考标准。
第二篇 紫外线表面消毒效果评价方法与标准
主题内容与适用范围
本方法规定了物体表面消毒用紫外线的波长、强度及评价其消毒效果的物理学指标和生物学检测方法。 本方法适用于紫外线直接照射到的物体表面消毒效果评价。
指示菌
- 大肠杆菌(8099或ATCC 25922)。
- 枯草杆菌黑色变种芽胞(ATCC 9372)。
物理学指标
- 在电压220V时,普通30W直管型紫外线灯,在室温为20~25℃的使用情况下,253.7nm紫外线辐射强度(垂直1m处)应≥70μW/cm2。
- 在电压220V时,高强度紫外线灯,在室温为20~25C的使用情况下,253.7nm紫外线辐射强度(垂直1m处)应≥200μW/cm2。
- 照射剂量按式(1)计算:剂量(μW·s/cm2)=强度(μW/cm2)×时间(s)………………………(1)
检测方法
- 物理学检测方法
- 灯管的紫外线强度(μW/cm2)用中心波长为253.7nm的紫外线强度测定仪(标定有效期内),在灯管垂直位置1m处测定。
- 在实际应用中消毒表面的照射强度应以灯管与消毒对象的实际距离测定。
- 表面消毒接受的照射剂量,应达杀灭目标微生物所需。对大肠杆菌,照射剂量应达到20000μW·s/cm2,对枯草杆菌黑色变种芽胞应达到100000μW·s/cm2。
- 生物学检测方法
- 采用载体定量消毒试验。载体制备按本标准附录C进行。
- 开启紫外线灯5min后,将8个染菌玻片平放于灭菌器皿中,水平放于适当距离照射,于4个不同间隔时间各取出2个染菌玻片,分别投入2个盛有5mL洗脱液(1%吐温80,1%蛋白胨生理盐水)试管中,振打80次。
- 经适当稀释后,取0.5mL洗脱液,作平板倾注,每个染菌玻片接种两个,放37℃培养48h作活菌计数。
- 阳性对照,除不作照射处理外,取2个染菌玻片分别投入2个盛有5mL洗脱液中振打80次,余按4.2.3进行。
- 计算杀灭率
判定标准
- 对指示菌杀灭率≥99.9%判为消毒合格。
- 达物理学检测标准时,作为消毒合格的参考标准。
第三篇 液体消毒剂消毒效果评价方法与标准
主题内容与适用范围
本方法具体规定了消毒剂消毒效果生物学检测方法及其评价标准。 本方法适用于消毒剂对各种物体的消毒效果评价。
理化指标
置20±2℃水浴中,测定在使用浓度下杀灭指示微生物达到消毒或灭菌所需的最短时间(min)。
指示微生物
- 细菌
- 细菌繁殖体:金黄色葡萄球菌(ATCC 6538)、大肠杆菌(8099或ATCC 25922)。
- 细菌芽胞:枯草杆菌黑色变种芽胞(ATCC 9732)。 15.2真菌:白色念珠菌(ATCC 10231)。
- 乙型肝炎表面抗原:纯化抗原(1.0mg/mL)。
- 检测方法
- 消毒效果评价标准
- 对细菌和真菌的杀灭率≥99.9%,对HBsAg,将检测方法灵敏度104倍或5×104倍(载体试验)的HBsAg抗原性破坏,可判为消毒合格。
- 1对枯草杆菌黑色变种芽胞全部杀灭,可判为灭菌合格。
- 1在实际应用中消毒效果评价以有机物保护试验的最低浓度和最短时间为该消毒剂达到实用消毒所需的浓度和时间。
附录A
中和剂中和效果试验
内容提要
为了准确评价消毒剂对微生物的杀灭作用,消毒试验中要求选择适当中和剂。所选中和剂不仅能及时中止消毒剂的杀微生物作用,且中和剂本身及其与消毒剂的反应产物(下称中和产物)尚需对微生物无抑制或杀灭作用,对培养基无不良影响。
培养基和试剂
- A2.1营养琼脂培养基
- 成分:
- 蛋白胨 10g
- 牛肉膏 3g
- 氯化钠 5g
- 琼脂 15g-20g
- 蒸馏水 1000ml
- 制法:除琼脂外,其他成分溶解于蒸馏水中,调pH至7.2-7.4,加入琼脂后加热溶解,过滤分装,经121℃、压力蒸汽作用30min,灭菌后备用。 A2.20.03mol/L磷酸盐缓冲液(pH7.2~7.6,下称PBS)。
- 20.03mol/L磷酸盐缓冲液(pH7.2~7.6,下称PBS)。
- 成分:
- 磷酸氢二钠 2.84g
- 磷酸二氢钾 1.36g
- 蒸馏水 1000.00ml
- 制法:将磷酸氢二钠与磷酸二氢钾溶解于蒸馏水中,pH为7.2~7.4,分装,经121℃、30min压力蒸汽灭菌后备用。
器材
- 锥形烧瓶。
- 平皿(直径9cm)。
- 量筒。
- 精密pH试纸。
- 无菌试管。
- 无菌刻度吸管(1.0,5.0,10.0ml)。
- 恒温培养箱。
- 冰箱。
- 菌落计数器。
- 酒精灯。
中和剂(注明生产厂家,批号)
操作方法
- 用PBS将指示菌制成5×105~5×106cfu/ml悬液。
- 将消毒剂用灭菌蒸馏水配制成3种不同浓度,在不加中和剂的情况下,测知该消毒剂10min抑杀指示菌99.9%以上的最低有效浓度。
- 取消毒剂10min抑杀指示菌的最低有效浓度与待选择中和剂进行试验,选出中和剂种类并依据等当量中和原则,调整中和剂浓度,选出试验浓度的消毒剂使用中和剂的浓度。
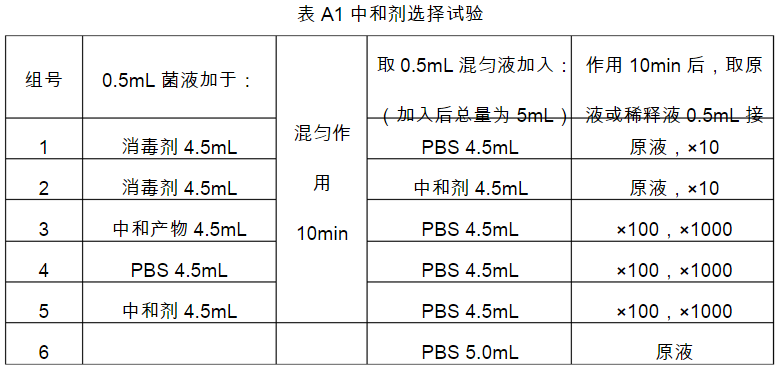
- A5.4中和剂选择试验时,先将消毒剂1.0ml与中和剂溶液9.0ml混合,制成中和产物溶液,再按表A1分组进行。
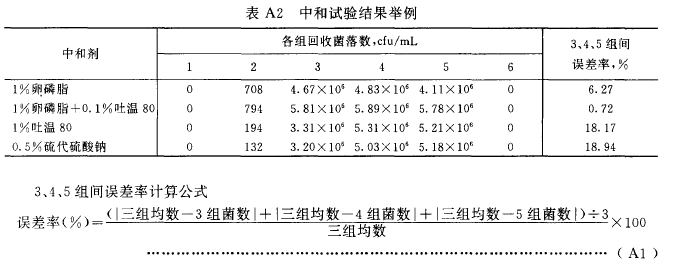
中和试验结果报告方法(如表A2)
判定标准
- A7.1:3、4、5组菌数相似,其误差率≤10%。
- A7.2:6组无菌生长。
- A7.3:2组菌数明显少于3、4、5组。
- A7.4:1组不长菌或明显少于2组。
符合上述标准的中和剂表明可消除消毒剂对指示菌的作用,中和剂及其与消毒剂的中和产物对指示菌无毒害,判定为该消毒剂的中和剂。
消毒试验用中和剂浓度的选择
按A5.4步骤进行,按A7.1~7.4的标准判定。
附录B
消毒剂定性消毒试验
内容提要
定性消毒试验是测定受消毒因子作用后的样本有无细菌生长的试验方法。用于对消毒因子灭菌效果的鉴定和消毒剂杀灭细菌效果的初步评价。
培养基与试剂
- 普通肉汤培养基
- 成分:
- 蛋白胨 10.00g
- 氯化钠 5.00g
- 肉浸液 1000.00ml
- 制法:取蛋白胨、氯化钠加入肉浸液内,微温溶解,调节pH至弱碱性,煮沸、滤清,调节pH使灭菌后为7.2~7.4,压力蒸汽灭菌备用。
- 试剂
- 稀释液:含1%蛋白胨的0.03mol/L PBS(pH7.2~7.4)。
- 2灭菌蒸馏水。
- 中和剂:按本标准附录A选择。
器材
- 灭菌刻度吸管(1.0,5.0,10.0mL)。
- 灭菌试管。
- 灭菌三角烧瓶。
- 酒精灯。
- 恒温水浴箱。
- 恒温培养箱。
试验方法
- 将菌液进行活菌计数,并用稀释液配制成含菌量为5×105~5×106cfu/mL的菌悬液。
- 将灭菌试管10支排列于试管架上,标记管号。
- 每个试管加灭菌蒸馏水2.5mL,放20±2℃水浴中。
- 于第1管内加适当浓度消毒液2.5mL,混匀后取2.5mL移入第2管,再次混匀,从第2管中取2.5mL移入第3管,以此类推至第9管,混匀后弃去2.5mL,第10管中不加消毒液作对照。
- 加菌悬液2.5mL于各管中,混匀并记录各管加菌时间,使菌药混合液中含菌量均为105~106cfu/ml。
- 6各管分别于加菌后4个不同间隔时间,取出0.5mL,加入4.5mL中和剂内,中和10min后,取出0.5mL加入4.5mL营养肉汤管内。
- 将接种细菌的肉汤管放37℃培养48h,观察初步结果,无菌生长管继续培养至第7天。
- 试验重复5次。
结果判定
- 若肉汤管混浊,则表示有菌生长,记为阳性,以(+)表示。
- 若培养至第7天,肉汤管澄清,则表示无菌生长,记为阴性,以(—)表示。
- 对难以判定的肉汤管,取0.1mL接种于营养琼脂平板,用灭菌L棒涂匀,放37℃培养48h,观察菌落形态;并做涂片染色镜检,判断是否有指示菌生长。有指示菌生长记为阳性。
- 5次试验,均无指示菌生长表示达到灭菌。
附录C
消毒剂定量消毒试验
内容提要
定量消毒试验是测定受消毒因子作用后,样本残存微生物数量的试验方法,以杀灭率表示结果。用于对消毒剂杀灭效果的评价。
培养基与试剂
- 普通营养琼脂培养基:按本标准A2.1制备。
- 试剂
- C2.2.1. 稀释液:含1%蛋白胨的0.03mol/L PBS(pH7.2~7.4)。
- 灭菌蒸馏水。
- 中和剂:按本标准附录A选择。
- 0.03mol/L PBS(pH7.2~7.4)。
- 洗脱液:含中和剂、1%蛋白胨、0.1%吐温80的PBS。
器材
- 灭菌刻度吸管(1.0,5.0,10.0mL)。
- 灭菌试管。
- 灭菌三角烧瓶。
- 灭菌平皿(直径为9cm)。
- 恒温水浴箱。
- 恒温培养箱。
- 酒精灯。
- 菌落计数器。
- 微量进样器。
- 载体:根据需要及试验目的选用经脱脂处理0.5cm×1.0cm大小的布片、纸片、玻片、橡胶片、塑料片、不锈钢片或铝片。
试验方法
- 定量悬液试验
- 将菌液进行活菌计数,并用稀释液稀释成含菌量为5×105~5×106cfu/mL的菌悬液。
- C4.1.2. 将消毒剂用灭菌蒸馏水稀释成3个不同浓度,各吸取4.5mL分别加入三个试管内,放20±2℃水浴中。
- 待试管内液体温度与水浴温度平衡后,在三个试管中分别加入0.5mL菌悬液(含菌量为5×105~5×106cfu/mL),混匀并开始记时。
- 分别于4个不同间隔时间,各取0.5mL菌液混合液移入4.5mL中和剂中混匀。
- C4.1.5. 中和10min,作适当稀释后进行活菌计数。
- 阳性对照以洗脱液代替消毒液,同时按C4.1.2~C4.1.5进行。
- 按不同稀释度推算出每个样本存活菌数(cfu/mL),按式(C1)计算杀灭率。
- C4.1.8. 试验重复5次。
- 载体定量试验
- 将灭菌载体平放于灭菌平皿内,每个载体滴注定量菌液(载体回收菌量达5×105~5×106cfu/片),涂匀,放37℃培养箱待干。应用市售染菌载体时,回收菌量亦应达5×105~5×106cfu/片)。
- C4.2.2. 用灭菌蒸馏水将消毒剂稀释成3个不同浓度,各吸取5mL分别加入三个试管内,放20±2℃水浴中。
- C4.2.3. 待试管内液体温度与水浴温度平衡后,加入染菌载体,作用至规定时间,将染菌载体移入含中和剂的5mL洗脱液试管内,中和10min,振打80次,适当稀释,接种两个平板。放37℃培养24~48h,进行活菌计数。
- 阳性对照,以洗脱液代替消毒液按C4.2.2~C4.2.3进行。
结果判定
- 5次试验的杀灭率均≥99.9%判为消毒合格。
- 对枯草杆菌黑色变种芽胞5次试验均全部杀灭判为消毒合格。
附录D
有机物保护试验
内容提要
有机物保护试验是测定消毒剂对有机物保护条件下的微生物的杀灭作用,以杀灭率表示之,其结果与该消毒剂定量消毒试验相比较,用于评价有机物对消毒剂的杀菌能力的影响。
培养基与试剂
- 普通营养琼脂培养基,按本标准A2.1制备。
- 试剂:
- 稀释液:同C2.2.1。
- 灭菌蒸馏水。
- 中和剂:按本标准附录A进行选择。
- 0.03mol/L磷酸缓冲液(pH7.2~7.4)(简称PBS)。
- 洗脱液:含1%蛋白胨,0.1%吐温80的生理盐水。
- 小牛血清加入菌悬液中,使其最终浓度为10%。
器材
同本标准附录C中器材。
试验方法
- 实验前预先将菌液进行活菌计数,用稀释液稀释,加入小牛血清,使其最终含血清量为10%,含菌数为5×105~5×106cfu/mL,以此作为试验菌悬液。
- 以下步骤同本标准C4.1.2~C4.1.8。
结果判定
- 5次试验的杀灭率均大于99.9%所需最低浓度和最短时间,判为该消毒剂在有机物存在下,可以达到消毒的有效浓度和时间。
- 此有效浓度和时间与定量消毒试验达到消毒的有效浓度和时间相同或相近,判为有机物对消毒剂杀菌作用无明显影响。达到消毒最低有效浓度增加一倍以上或最短作用时间延长一倍以上者可视为有明显影响。
附录E
乙型肝炎表面抗原破坏试验
内容提要
乙型肝炎表面抗原(HBsAg)破坏试验是以HBsAg的抗原活性为间接标志,评价消毒因子对乙型肝炎病毒(HBV)灭活能力的试验方法。
适用于评价化学消毒剂、紫外线对HBV的消毒效果。
试剂
- 小牛血清(56℃,30min灭活)
- 0.01mol/L磷酸盐缓冲液(PBS,pH7.2~7.4)。
- 纯化HBsAg(1.0mg/mL)。
- 固相放射免疫分析法试剂,要求特异性100%,精密性CV≤15%,灵敏度≤1.0ng/mL,线性r>0.95。
- 酶联免疫吸附法试剂,要求特异性100%,精密性CV≤15%,灵敏度≤3.2ng/mL,线性r>0.95。
器材
- 吸量器:包括试管、吸管(0.1,1.0,5.0和10.0mL4种)和微量进样器(100.0μL)。
- 载体(直径1.5cm大小的不锈钢片)。
- 免疫计数仪。
- 酶联免疫测定仪。
- 低温冰箱(—30℃~—70℃)。
HBsAg悬液的配制
- 取0.01mol/LPBS(pH7.2~7.4)9.4mL加入小牛血清0.6mL,配成含6%小牛血清的悬液。再取该PBS 9.0mL,加入浓度为1.0mg/mL的纯化HBsAg悬液1.0mL,使成含5.4%小牛血清,HBsAg浓度为100μg/mL的试验用HBsAg悬液。
- 将试验用HBsAg悬液1.0mL盛装入容量为1.5mL的玻璃安瓿中,封口,放-30℃~-70℃冰箱保存备用。保存期为三个月。
HBsAg的检测方法
- 固相放射免疫分析法(SPRIA)。
- 酶联免疫吸附法(ELISA)。
中和剂选择
在测定消毒剂对HBsAg的破坏效果时,应先选出适宜的中和剂及其使用浓度,再进行破坏试验。
所用中和剂:a.应能有效而及时中止消毒剂的残余作用;b.中和剂及其与消毒剂的中和产物对HBsAg的抗原活性没有影响,亦不影响检测方法对HBsAg检出的灵敏度。
- 将消毒剂用无菌蒸馏水配成不同浓度,取1.2mL消毒液与0.3mLHBsAg悬液混匀,置20±2℃水浴条件下,作用10min,测定该消毒剂10min抑制或破坏HBsAg抗原性的最低有效浓度。
- 取消毒剂10min抑制或破坏HBsAg抗原性的最低有效浓度与待选中和剂进行试验,试验可按下列组别进行:a.消毒液0.9mL+HBsAg悬液0.1mL;b.消毒液0.4mL+HBsAg悬液0.1mL作用10min后+含20%小牛血清的中和剂0.5mL;c.先取含20%小牛血清的中和剂1mL与消毒液1mL,混匀,作用10~30min,制成中和产物溶液,再行试验。中和产物溶液0.9mL+HBsAg悬液0.1mL;d.含10%小牛血清的PBS0.9mL+HBsAg悬液0.1mL;e.含10%小牛血清的中和剂0.9mL+HBsAg悬液0.1mL;f.中和产物溶液0.9mL+PBs0.1mL。经检测只有在c、d、e组HBsAg活性的测定值相近(相差10%以下)并都明显多于b组,a组HBsAg活性不能检出或检出活性明显少于b组,f组阴性对照正常,方可证明所选中和剂及其使用剂量是适宜的。
- 进行消毒试验时,依据消毒剂与中和剂等当量中和原则,适当调整中和剂的用量。再次按E6.2步骤测定中和效果后,方可进行抗原性破坏试验。
破坏试验方法
- 悬液法
- 悬液法指将HBsAg在悬液中与消毒剂相互作用并进行抗原性破坏效果观察的试验方法。
- HBsAg悬液的浓度为检测试剂灵敏度的104倍。如检测试剂的灵敏度为1ng/mL,HBsAg的浓度应为10μg/mL。
- 取含5%小牛血清的PBS2.7mL加到含0.3mL浓度为100μg/mL的HBsAg悬液中,混匀。
- 取小牛血清20mL加到含80mL灭菌的中和剂溶液中,混匀。
- 破坏试验:将预定消毒液浓度1.25倍的消毒液与HBsAg悬液按4∶1比例混合,混合液容量不少于1.5mL。然后置20±2℃水浴条件下,作用达规定时间,即刻取0.3mL混合液与等体积含20%小牛血清的中和剂混匀,作用10~30min,取样测定残留HBsAg的活性,每一样本平行测定2份,每份0.1mL,取其平均值,判定破坏效果。每种消毒剂观察3个浓度,每一浓度观察4个作用时间。试验重复5次。
- 阳性对照:取含20%小牛血清的中和剂1mL,加到含1mL试验用消毒液的试管中混匀,作用10~30min,制成中和产物溶液。取该中和产物溶液0.9mL加入试验浓度的HBsAg悬液0.1mL取样检测,每一样本检测3份,每份0.1mL,取其平均值为阳性对照值。
- 阴性对照:取含20%小牛血清的中和剂1mL加到含1mL试验用消毒液的试管中,混匀,作用10~30min,取样检测,每一样本检测3份,每份0.1mL取其平均值为阴性对照值。
- 应注意阴性对照不能用试剂盒的阴性对照样本。
- 载体法
- 载体法指将在载体表面的HBsAg与消毒因子相互作用,并进行抗原性破坏效果观察的试验方法。
- HBsAg载体的制备
- 载体为直径1.5cm大小的不锈钢片,经洗涤剂煮沸洗涤脱脂、压力蒸汽灭菌备用。
- HBsAg悬液的浓度为检测方法灵敏度的5×104倍。如灵敏度为1ng/mL,HBsAg的浓度应为50μg/mL。
- HBsAg的污染方法为滴染法。滴染时,将灭菌载体平铺于无菌平皿内,用微量进样器吸取HBsAg悬液,滴注于载体中央,每个载体20μL。然后用L型白金丝将悬液涂布均匀,放37℃培养箱40~60min,待悬液干燥后进行抗原性破坏试验。
- 抗原性破坏试验
- 取污染HBsAg的载体,平放于无菌平皿内,用吸管吸取预定浓度的消毒液50μL,滴注于载体中央,迅即涂匀,使整个载体均匀受药。每2片一组,置20±2℃水浴中,作用至规定时间后,用无菌镊子将载体移入含1.0mL10%小牛血清的中和剂试管中。作用10~30min,敲打振荡200次,取样检测残留HB-sAg的活性,每一样本取样2份,每份0.1mL,取其平均值,判定抗原性的破坏效果。每种消毒剂观察3个浓度,每个浓度观察4个作用时间。
试验重复5次。
- 在观察紫外线破坏HBsAg的效果时,将污染载体直接置作用因子下,作用至规定剂量后将载体移入含1.0mL10%小牛血清PBS的试管中,敲打振荡200次,取样检测残留HBsAg活性,每一样本取样2份,每份0.1mL,取其均值,判定破坏效果。试验重复5次。
- 阳性对照
- 在观察消毒剂破坏HBsAg效果时,取50μL试验用消毒液加到含1.0mL10%小牛血清中和剂的试管中,作用10~30min,制成中和产物溶液。取该中和产物溶液1.0mL加到大试管中,然后将滴染HB-sAg的载体移入,敲打振荡200次,每一样本检测3份,每份0.1mL,取其平均值为阳性对照值。
- 在观察紫外线破坏HBsAg效果时,将污染HBsAg的载体直接移入含1.0mL10%小牛血清的PBS(PH7.2~7.4)的试管中,敲打振荡200次,每一样本检测3份,每份0.1mL,取其平均值为阳性对照值。
- 阴性对照
- 在观察消毒剂破坏HBsAg效果时,取50μL消毒液加到含1mL 10%小牛血清中和剂试管中,作用10~30min,取样检测,每一样本检测3份,每份0.1mL。取其平均值为阴性对照值。
- 在观察紫外线破坏HBsAg时,阴性对照则为含10%小牛血清的PBS(pH7.2~7.4)。每一样本检测3份,每份0.1mL,取其平均值为阴性对照值。
- 应注意阴性对照不能用试剂盒的阴性对照样本。
破坏效果判定
以S/N<2.1作为HBsAg抗原性破坏合格标准。其中S是消毒因子作用后被检样品或阳性对照样品平均每分钟脉冲数(cpm)值或光密度(OD)值。N是试验中阴性对照样品平均cpm值或OD值。